ДНК-микрочип
Материал из MachineLearning.
м (→Предобработка данных эксперимента) |
м (→Контроль качества) |
||
| (4 промежуточные версии не показаны) | |||
| Строка 8: | Строка 8: | ||
== Пример использования ДНК-микрочипа == | == Пример использования ДНК-микрочипа == | ||
Ниже приводится пример эксперимента с использованием ДНК-микрочипа. | Ниже приводится пример эксперимента с использованием ДНК-микрочипа. | ||
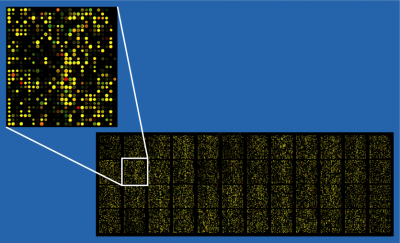
| - | [[Изображение:Microarray raw.png|thumb|300px|Результат сканирования | + | [[Изображение:Microarray raw.png|thumb|300px|Результат сканирования однокрасочного микрочипа]] |
# Выделяются или выращиваются биологические образцы, которые необходимо сравнить. Они могут соответствовать одним и тем же индивидуумам до и после какого-либо лечения (случай парных сравнений), либо различным группам индивидуумов, например, больным и здоровым, и т. д. | # Выделяются или выращиваются биологические образцы, которые необходимо сравнить. Они могут соответствовать одним и тем же индивидуумам до и после какого-либо лечения (случай парных сравнений), либо различным группам индивидуумов, например, больным и здоровым, и т. д. | ||
# Из образца выделяется очищенная нуклеиновая кислота, являющаяся объектом исследования: это может быть [[РНК]] в исследовании профиля [[экспрессия генов|экспрессии генов]], [[ДНК]] при изучении сравнительной геномной гибридизации и т.д. Данный пример соответствует первому случаю. | # Из образца выделяется очищенная нуклеиновая кислота, являющаяся объектом исследования: это может быть [[РНК]] в исследовании профиля [[экспрессия генов|экспрессии генов]], [[ДНК]] при изучении сравнительной геномной гибридизации и т.д. Данный пример соответствует первому случаю. | ||
| Строка 39: | Строка 39: | ||
=== Суммаризация === | === Суммаризация === | ||
| + | {{Main|Суммаризация в анализе ДНК-микрочипов}} | ||
| + | |||
Обобщение значений уровня экспрессии по всем пробам, соответствующим одинаковым последовательностям | Обобщение значений уровня экспрессии по всем пробам, соответствующим одинаковым последовательностям | ||
| + | |||
=== Контроль качества === | === Контроль качества === | ||
| + | {{Main|Контроль качества в анализе ДНК-микрочипов}} | ||
Обработка выбросов | Обработка выбросов | ||
== Основной этап статистической обработки == | == Основной этап статистической обработки == | ||
| - | Множественная проверка гипотез, кластеризация, методы машинного обучения | + | [[Множественная проверка гипотез]], [[кластеризация]], методы машинного обучения |
| + | |||
== Пост-обработка результатов == | == Пост-обработка результатов == | ||
Объединение отобранных генов в имеющие биологический смысл группы | Объединение отобранных генов в имеющие биологический смысл группы | ||
| Строка 58: | Строка 63: | ||
* [http://en.wikipedia.org/wiki/DNA_microarray_experiment DNA microarray experiment] - статья из английской Википедии | * [http://en.wikipedia.org/wiki/DNA_microarray_experiment DNA microarray experiment] - статья из английской Википедии | ||
* [http://learn.genetics.utah.edu/content/labs/microarray/ DNA Microarray Virtual Lab] - пошаговый интерактивный пример эксперимента с двукрасочным ДНК-микрочипом | * [http://learn.genetics.utah.edu/content/labs/microarray/ DNA Microarray Virtual Lab] - пошаговый интерактивный пример эксперимента с двукрасочным ДНК-микрочипом | ||
| + | * [http://www.chem.agilent.com/Library/applications/10_pitfalls_technote72.pdf Ten Pitfalls of Microarray Analysis] - распространённые ошибки анализа ДНК-микрочипов | ||
== Примечания == | == Примечания == | ||
Текущая версия
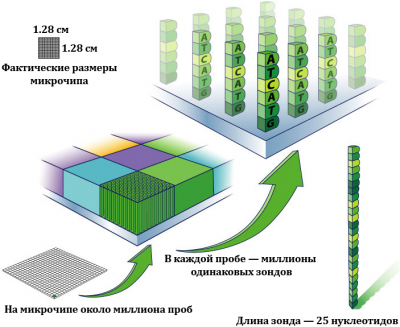
ДНК-микрочип (англ. DNA microarray) — это сложная технология, используемая в молекулярной биологии и медицине. ДНК-микрочип представляет собой небольшую поверхность, на которую с большой плотностью в определённом порядке нанесены фрагменты одноцепочечной синтетической ДНК с известной последовательностью. Эти фрагменты выступают в роли зондов, с которыми гибридизуются (образуют двуцепочечные молекулы) комплементарные им цепи ДНК из исследуемого образца, обычно меченные флуоресцентным красителем. Чем больше в образце молекул ДНК с определенной последовательностью, тем большее их количество свяжется с комплементарным зондом, и тем сильнее будет оптический сигнал в точке микрочипа, куда был «посажен» соответствующий зонд. После гибридизации поверхность микрочипа сканируется, и в результате каждой последовательности ДНК ставится в соответствие тот или иной уровень сигнала, пропорциональный числу молекул ДНК с данной последовательностью, присутствующих в смеси.
В обычном ДНК микрочипе (н-р, производства Affymetrix) зонды прикрепляются к твердой поверхности — стеклянному или силиконовому чипу. Другие платформы, например, выпускаемые Illumina, используют микроскопические шарики вместо больших твердых поверхностей. Технология ДНК-микрочипов находит самые разнообразные применения в современной биологии и медицине для анализа сложных смесей ДНК — например, совокупности всех транскриптов (матричных РНК) в клетке. ДНК микрочипы используют для анализа изменения экспрессии генов, выявления однонуклеотидных полиморфизмов, генотипирования или повторного секвенирования мутантных геномов. Микрочипы отличаются по конструкции, особенностям работы, точности, эффективности и стоимости.
Содержание |
Пример использования ДНК-микрочипа
Ниже приводится пример эксперимента с использованием ДНК-микрочипа.
- Выделяются или выращиваются биологические образцы, которые необходимо сравнить. Они могут соответствовать одним и тем же индивидуумам до и после какого-либо лечения (случай парных сравнений), либо различным группам индивидуумов, например, больным и здоровым, и т. д.
- Из образца выделяется очищенная нуклеиновая кислота, являющаяся объектом исследования: это может быть РНК в исследовании профиля экспрессии генов, ДНК при изучении сравнительной геномной гибридизации и т.д. Данный пример соответствует первому случаю.
- Проверяется качество и количество полученной нуклеиновой кислоты. Если требования соблюдены, эксперимент может быть продолжен.
- На основе имеющихся образцов РНК в процессе обратной транскрипции синтезируются последовательности комплементарных ДНК (кДНК, англ. cDNA).
- В процессе амплификации (синтеза дополнительных копий ДНК) количество последовательностей кДНК в образцах многократно увеличивается.
- К концам последовательностей кДНК присоединяются флуоресцентные или радиоактивные метки.
- Полученные образцы в смеси с необходимыми химическими веществами через микроскопическое отверстие наносятся на ДНК-микрочипы и начинается процесс гибридизации, в ходе которого одна из цепей кДНК присоединяется к комплементарной ей цепи, имеющейся на микрочипе.
- После окончания процесса гибридизации чипы промываются для удаления остатков материала.
- Полученные микрочипы сканируются при помощи лазера. На выходе получается одно- или двухцветные изображения (в зависимости от количества использованных красителей).
- На каждое изображение накладывается сетка, так, что каждой её ячейке соответствует участок чипа с пробами одного типа. Интенсивности свечения проб в ячейке сетки ставится в соответствие некоторое число, которое, в самом первом приближении, может служить мерой количества присутствовавших последовательностей РНК в соответствующем образце.
Дальнейшая обработка результатов требует многоэтапного привлечения сложного статистического аппарата.
Предобработка данных эксперимента
Корреляция между интенсивностями двух проб одного ДНК-микрочипа, представляющих один и тот же ген, обычно превышает 95%. Часто этот факт интерпретируют как подтверждение хорошей воспроизводимости экспериментов с чипами. Однако, если один и тот же биологические материал разделить на две части и сделать с ними разные микрочипы, корреляция между полученными интенсивностями, скорее всего, будет составлять от 60 до 80%. Корреляция на чипах с образцами, взятыми у мышей из одного помёта, может опускаться до 30%. Если эксперименты проводятся в разных лабораториях, корреляция между их результатами может быть ещё ниже[1].
Такая низкая воспроизводимость интенсивностей связана с совокупным воздействием большого количества источников вариации. Их можно разделить на три большие группы. Биологическая вариация включает неотъемлемые особенности организмов. Техническая вариация появляется на этапе выделения образцов, их окрашивания и гибридизации. Погрешность измерения связана со сканированием готовых массивов, на результаты которого может повлиять, например, пыль внутри сканера.
Нейтрализация эффектов технической вариации и ошибки измерения производится на этапе предобработки ДНК-микрочипов.
Фоновая поправка
Необходимость фоновой поправки связана с наличием таких мешающих факторов, как шум оптической системы распознавания (данные интенсивности, полученные при сканировании, не равны "настоящим" интенсивностям проб) и неспецифическая гибридизация (присоединение нуклеотидных последовательностей к зондам чужих проб).
Нормализация
Нормализация данных позволяет сделать несколько рассматриваемых в эксперименте чипов пригодными к сравнению между собой. Основная цель анализа на этом этапе - исключить влияние систематических небиологических различий между микрочипами. Источников таких различий множество: вариации эффективности обратной транскрипции, маркировки красителями, гибридизации, физические различия между чипами, небольшие различия в концентрации реагентов, вариация лабораторных условий.
Показано, что выбор метода нормализации оказывает существенное влияние на результат анализа[1].
Суммаризация
Обобщение значений уровня экспрессии по всем пробам, соответствующим одинаковым последовательностям
Контроль качества
Обработка выбросов
Основной этап статистической обработки
Множественная проверка гипотез, кластеризация, методы машинного обучения
Пост-обработка результатов
Объединение отобранных генов в имеющие биологический смысл группы
Affymetrix GeneChip
Наиболее часто ДНК-микрочипы применяются для оценки экспрессии генов. Наиболее популярная платформа для решения этого класса задач - микрочипы Affymetrix GeneChip, использующие короткие последовательности олигонуклеотидов для выявления генов, содержащихся в образце РНК. Присутствие в образце каждого гена фиксируется при помощи совокупности зондов длиной в 25 нуклеотидов каждый. Для улучшения качества эксперимента на чипе размещается несколько копий зондов на каждую рассматриваемую последовательность.Микрочипы Affymetrix обычно используют от 11 до 20 пар проб на каждый изучаемый ген. Одна компонента таких пар, называемая perfect match probe (PM), в точности комплементарна последовательности соответствующего гена - подразумевается, что именно его РНК будет присоединяться к PM-зонду. Такое присоединение называется специфической гибридизацией. Тем не менее, к зондам могут присоединяться нуклеотидные последовательности и других генов (неспецифическая гибридизация). Для оценки воздействия неспецифической гибридизации используется другие компоненты пары - зонды, называемые mismatch probe (MM). Последовательность нуклеотидов в них совпадает с последовательностью в соответствующих PM-пробах с заменой центрального (тринадцатого) нуклеотида на комплементарный. Соотношение интенсивности свечения PM- и MM-проб изначально использовалось для нейтрализации эффекта неспецифической гибридизации, однако более поздние исследования поставили под сомнение правильность подобного подхода. Подробнее см. Фоновая поправка в анализе ДНК-микрочипов.
Ссылки
- DNA microarray - статья из английской Википедии
- DNA microarray experiment - статья из английской Википедии
- DNA Microarray Virtual Lab - пошаговый интерактивный пример эксперимента с двукрасочным ДНК-микрочипом
- Ten Pitfalls of Microarray Analysis - распространённые ошибки анализа ДНК-микрочипов